
Nguyên lý cơ bản
Điện di là quá trình dịch chuyển của phân tử tích điện trong dung dịch dưới tác dụng của điện trường. Điện di thường được phân loại dựa vào sự có mặt hoặc vắng mặt của môi trường hoặc chất nền rắn nơi mà phân tử tích điện dịch chuyển. Hệ thống điện di dung dịch sử dụng hệ đệm dung dịch thay cho môi trường rắn, những hệ thống như vậy có thể chịu ảnh hưởng bởi sự xáo trộn mẫu do có sự khuếch tán của phân tử tích điện, làm giảm độ phân giải trong quá trình ứng dụng, phân tách và các bước loại bỏ mẫu. Như vậy hệ thống điện di dung dịch phải sử dụng một vài phương tiện nhằm ổn định dung dịch trong tế bào điện di. Ví dụ: hệ thống điện di độ chênh hòa tan sử dụng các chất tan không có ion với mật độ khác nhau (Vd: Đường sucrose hoặc glycerol) để giảm thiểu độ khuếch tán của vật chất được tách ra trong quá trình điện di như Hình 1. Nhưng ngay cả có những cải tiến thì hệ thống phân tách điện di vẫn còn hạn chế đó là khi dùng cho việc chuẩn bị tỷ lệ xích vật chất (preparative scale: preparative là một từ tối nghĩa, trong công nghệ sinh học nó có nghĩa là việc cô lập vài mili gram vật chất cho việc đánh giá hoạt động sinh lý học của nó) bằng phân tách điện di.

Hình 1: Hệ thống điện di dung dịch.
Ứng dụng thiết thực nhất của phương pháp điện di trong công nghệ hóa sinh là điện di vùng (zonal electrophoresis), trong đó dung dịch ion có vai trò như một khuôn đỡ rắn và mẫu sẽ được đưa vào dưới dạng điểm hoặc băng vật chất. Giấy điện di, dải cellulose acetate, dải cellulose nitrate và gel điện di là những thành phần của hệ thống điện di (Hình 2). Những hệ thống này thông thông thường được sử dụng cho phân tích hơn là việc chuẩn bị tỷ lệ xích vật chất (preparative scale).

Hình 2: Hai hệ thống điện di vùng (zonal electrophoresis).
Tất cả các dạng của hệ thống điện di đều tuân theo quy luật như trong phương trình (*) sau đây:
(*) Độ linh động của phân tử = 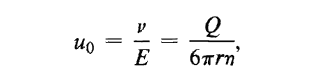
Độ linh động hoặc tốc độ chuyển động của phân tử tăng lên khi hiệu điện thế và điện tích của phân tử tăng lên và ngược lại độ linh động giảm khi ma sát giữa các phân tử hoặc độ nhớt của môi trường tăng làm cản trở dòng chảy. Tổng chuyển động thực tế của các phân tử tăng dần theo thời gian vì thế độ linh động được định nghĩa là tốc độ của sự di chuyển, phương trình (*) là phương trình cực kỳ quan trọng trong ngành hóa sinh thực nghiệm. Tất cả các hệ thống điện di đều sử dụng một hiệu điện thế bằng nhau và không đổi trên toàn bộ tiết diện cắt ngang của dải giấy, gel hay dung dịch dùng trong phân tách điện di. Đơn vị của điện trường là V/cm (độ lớn của nó được xác định bằng giá trị của điện áp), và theo định luật Ohm (V = IR) ta có điện áp V là hàm của dòng điện I và điện trở R, điện trở của hệ thống được quyết định bởi bản chất của thiết bị điện di và thành phần bộ đệm. Do đó dòng điện (vd: mA) thường được dùng để xác định yêu cầu về hiệu điện thế của phép phân tách điện di. Điện trở của hệ thống là thành phần rất quan trọng vì nó sẽ quyết định lượng nhiệt sinh ra trong quá trình điện di. Khi mà độ linh động điện di cũng phụ thuộc vào nhiệt độ do đó nhiệt độ của chất nền phân tách phải được điều khiển. Nếu một lượng nhiệt đủ lớn xuất hiện trong quá trình điện di thì yêu cầu hệ thống phải có một số thiết bị làm mát để duy trì được nhiệt độ không đổi trong suốt quá trình làm việc. Các mô hình “smiling” thường thấy trên phiến gel điện di là kết quả của sự gia nhiệt không đồng dạng của nó.
Nếu điện áp hoặc dòng điện được cấp cho hệ thống điện di là không đổi trong suốt quá trình phân tách điện di thì độ linh động của phân tử sẽ phụ thuộc vào các thành phần là dòng điện tích và tính ma sát của phân tử trong mẫu. Xét quá trình phân tách điện di trên giấy của acid glutamine, este methyl asaparagine và glycinamide tại giá trị pH 6.0. Điện tích và khối lượng phân tử của các hợp chất được mô tả trong Hình 3.

Hình 3: Phân tách bằng điện di giấy của acid glutamic, glutamine, asparagine, methyl ester và glycinamide tại pH 6.0. Glycinamide, có điện tích +1 và khối lượng phân tử là 75 có thể không nhất thiết di chuyển nhanh gấp hai lần với asparagine methyl ester có cùng điện tích nhưng có kích thước gấp hai lần. Đặc biệt, tính chất của đệm có thể ảnh hưởng đến sự phân bố độ ma sát của các phân tử nhỏ. Lực ion cao hơn có thể làm giảm sự phân bố ma sát.
Ta thấy các acid amin cùng kích thước và este methyl asparagine được phân tách tuân theo hàm về điện tích của chúng ở giá trị pH 6.0 trong khi glycinamite (có cùng điện tích nhưng kích thước chỉ bằng nửa so với este methyl asparagines) lại di chuyển xa hơn về phía cực âm (-) của hệ thống.
Nói chung các nguyên lý được minh họa trong Hình 3 có thể được sử dụng để minh họa tính linh động của phân tử ion cỡ nhỏ. Các nguyên lý này đặc biệt hữu ích cho việc tiên đoán khả năng phân tách điện di của các phân tử nhỏ chứa các nhóm có tính acid hoặc bazơ yếu, các phân tử này chỉ mang theo một phần điện tích trung bình trong dải pH liên quan đến phép chuẩn của chúng, ví dụ trong phân tách điện di của các nucleotide hoặc các acid amin.
Sự phân tách điện di của các phân tử lớn hơn các đại phân tử tuân theo nguyên lý của phương trình (*) nhưng các yếu tố khác sẽ ảnh hưởng đến độ phân giải của các đại phân tử. Độ ma sát của phân tử trong quá trình di chuyển điện di bị ảnh hưởng bởi cả hai yếu tố là hình dạng và kích thước của phân tử. Nếu quá trình điện di được thực hiện trong một môi trường có các rào cản có tác dụng cản trở đáng kể sự chuyển động của các đại phân tử thông qua nó (ví dụ như hai hệ thống thường được dùng là polyacrylamide và agarose) lúc này kích thước phân tử được chứng minh là yếu tố quan trọng nhất quyết định tính linh động của nó. Nếu tỷ lệ điện tích/khối lượng của đại phân tử được phân tách là xấp xỉ như nhau thì kích thước của phân tử là yếu tố duy nhất ảnh hưởng đến tính di động điện di. Những điều kiện này đang được sử dụng để xác định khối lượng phân tử của tiểu phần protein bằng phương pháp điện di trên gel polyacrylamide có chứa natri dodecyl sunphát (SDS-PAGE), và trong phân tách điện di của các thang oligonucleotide trong quá trình giải trình tự ADN. Đối với phân tử cỡ nhỏ có các liên kết có thể xoay tự do, do đó hình dạng phân tử không ảnh hưởng nhiều đến ma sát, nên điều quyết định chính đến độ ma sát là kích thước của phân tử. Tuy nhiên các đại phân tử thường có hình dạng xác định với tỷ lệ cụ thể của các trục (ví dụ tỷ lệ chiều dài với chiều rộng) kết quả là cả hình dạng và kích thước đều ảnh hưởng tới sự di chuyển của phân tử. Phân tử có tỷ lệ lớn giữa các trục (hình dạng thuôn dài) thể hiện tính linh động trong quá trình điện di thấp hơn so với phân tử dạng hình cầu có điện tích và khối lượng bằng nhau. Ngoài ra các đại phân tử có tính linh động không giống với nguyên lý điện di từ phương trình (*) bởi vì sự tương tác của nó với các ion hoặc do sự phụ thuộc của điện tích vào sự liên kết của các nội phân tử.
2. Các dạng đặc trưng của điện di thường được sử dụng trong công nghệ sinh học
– Điện di giấy ( Paper Electrophoresis): Điện di trên giấy là phương pháp điện di thường được sử dụng để phân tích và phân giải các phân tử cỡ nhỏ. Phương pháp này không được sử dụng để phân giải các đại phân tử (ví dụ protein…) bởi vì sự hấp thụ và sức căng bề mặt liên kết với giấy điện di thường làm thay đổi hoặc biến tính các đại phân tử tạo ra độ phân giải kém.
Có hai phương pháp điện di giấy.
Đối với quy trình khô, mẫu của chất tan được hòa tan trong nước hoặc một bộ đệm dễ bay hơi sau đó nó được nhỏ một giọt nhỏ hoặc sọc mỏng lên đường gốc (origin line) hoặc đường chì (pencil line) trên giấy, sau đó các hợp chất tiêu chuẩn thích hợp đã biết được đưa vào các vị trí khác trên đường gốc của giấy. Nếu bạn dự đoán được rằng sự di chuyển điện di sẽ về cả hai phía điện cực của hệ thống thì đường gốc nên được đặt tại tâm của giấy, còn nếu sự di chuyển điện di chỉ theo một hướng điện cực thì đường gốc nên được đặt tại gần một đầu (rìa) của giấy. Sau khi dung môi hòa tan có chứa các mẫu đã bay hơi hết, giấy được làm ẩm với đệm điện di bằng cách phun đồng nhất hoặc ngâm thấm các đầu của tờ giấy để làm ẩm cả 2 đầu và đường gốc của nó.
Quy trình ướt, mẫu dung dịch cô đặc trong nước cất được nhỏ lên trên giấy trước khi được làm ẩm với đệm điện di. Quy trình khô có lợi thế so với quy trình ướt đó là cho phép điểm mẫu ban đầu nhỏ và độ phân giải tốt hơn đối với những hợp chất có cùng độ linh động. Tuy nhiên quy trình khô khá bất tiện bởi vì việc nhúng và phun đòi hỏi kỹ năng thao tác để ngăn việc làm dây mẫu ra ngoài. Quy trình ướt đơn giản hơn nhiều nhưng giọt mẫu điểm thường lớn hơn và độ phân giải thu được kém hơn do sự khuếch tán của mẫu.
Sau khi mẫu được đặt lên mảnh giấy ẩm, giấy này được đưa vào buồng điện di để cho cả hai đầu của giấy đều tiếp xúc với bình chứa bộ đệm điện di và các điện cực (Hình 4). Nếu đường gốc không nằm tại tâm của tờ giấy thì tờ giấy phải được định vị sao cho có thể cho phép tối đa sự di chuyển về phía điện cực mong muốn. Sau đó buồng điện di được đóng lại để ngăn sốc điện và điện trường sẽ được cấp cho hệ thống.
Dưới tác dụng của điện trường và điện trở lên dòng điện, bộ đệm giấy sinh ra nhiệt, đây là vấn đề lớn và khó khăn nhất đối với phương pháp điện di trên giấy bởi vì nhiệt sinh ra có tác dụng sấy khô giấy làm cản trở dòng điện và kết quả làm cho điện trở lại tăng lên v.v. Kể cả nếu ta có thể ngăn chặn quá trình bị sấy khô của giấy bởi nhiệt thì lượng nhiệt sinh ra này vẫn làm thay đổi tính chất dòng điện và trở kháng của hệ thống làm biến dạng sự di chuyển của phân tử.

Hình 4: Hai hệ thống điện di giấy.
Bởi vì những khó khăn trên nên các hệ thống điện di trên giấy hiện đại đã được thiết kế để khắc phục những vấn đề về nhiệt lượng sinh ra. Hầu hết các thiết bị sử dụng điện áp thấp được thiết kế dưới dạng nhỏ gọn cơ động và nó có thể được vận hành trong phòng lạnh hoặc trong buồng đông lạnh. Ngược lại các thiết bị sử dụng điện áp cao thường sử dụng hệ thống làm mát dạng giường phẳng hoặc được vận hành trong một bồn làm mát chứa dung môi trơ và không phân cực (ví dụ: Varso-một sản phẩm từ chưng cất dầu mỏ). Dung dịch này hấp thụ nhiệt tỏa ra từ hệ thống mà không cần trộn với nước, bộ đệm hoặc các mẫu trên giấy (Hình 4). Sau khi điện di các mẫu trên giấy với thời gian và điện áp yêu cầu cho sự phân tách tối ưu, dòng điện sẽ được ngắt, giấy được lấy ra khỏi hệ thống và được sấy khô sau đó ta có thể xác định được sự hiện diện và vị trí của các phân tử cần quan tâm.
– Điện di mao quản (Capillary Electrophoresis): Đây là một phương pháp mới cho sự phân tích điện di và có ứng dụng ngày càng nhiều trong nghiên cứu sinh hóa.
Tên của phương pháp đã giúp ta phần nào đoán được nguyên lý hoạt động của nó, trong đó vật chất được phân tích và môi trường điện di được đặt trong một ống mao dẫn mịn, dài (thông thường dài từ 50 đến 100cm và đường kính trong từ 15 đến 100 μm). Một lượng mẫu rất nhỏ (cỡ nano lít) được đặt tại một đầu của ống mao dẫn và chịu sự điện di dưới trường tạo bởi điện áp từ 20 đến 30kV. Chất phân tích sẽ được phân tách tuân theo nguyên lý của phương trình (*) và được phát hiện khi chúng xuất hiện ở đều bên kia của ống mao dẫn thông thường là bằng phương pháp sắc kí lỏng hiệu năng cao. Ưu điểm của điện di mao dẫn là nó cho độ phân giải cực cao, tốc độ và độ nhạy cao đối với việc phân tích các mẫu rất nhỏ nhưng rõ ràng nó không thực sự hữu ích trong phương pháp chuẩn bị vật liệu (preparative). Nó thường sử dụng trong việc phân tách các phân tử ADN có kích thước khác nhau chỉ một nucleotit đơn lẻ. Bởi vì phương pháp điện di mao dẫn có độ phân giải rất cao, nên nó là cơ sở để phân tách các polynucleotide trong trình tự ADN kiểu mới. Phương pháp điện di mao dẫn cũng phù hợp với sự phân tách các phân tử không tích điện bằng cách thêm các vi hạt tích điện vào trong môi trường dung dịch điện di. Nếu hỗn hợp dung dịch hòa tan được ngăn cách giữa môi trường nước và phần kỵ nước bên trong của vi hạt được đưa vào trong hệ thống này thì chúng có thể được phân tách bằng phương pháp điện di. Điện di mao dẫn là một phương pháp có tính linh động cao, phạm vi ứng dụng và phương pháp tối ưu hóa cho nó vẫn đang được nghiên cứu.
– Điện di trên gel ( Gel Electrophoresis): Đối với phương pháp điện di trên gel, phân tử được phân tách trong hệ đệm lỏng được hỗ trợ trong một chất nền polime. Hệ thống điện di trên gel có một số ưu điểm rõ rệt. Đầu tiên, chúng có thể thích hợp trên những mẫu lớn hơn so với hầu hết các hệ thống điện di giấy, và cũng có thể sử dụng cho việc chuẩn bị tỷ lệ xích (preparative scale) cho các đại phân tử. Thứ hai là tính chất của chất nền gel có thể thay đổi theo ý muốn để phù hợp với những ứng dụng cụ thể, bởi vì gel làm tăng độ ma sát và điều chỉnh sự linh động điện di (xem phương trình (*)). Vật liệu để làm chất nền có nồng độ thấp hoặc mức độ thấp các liên kết chéo của các monomer trong hệ thống gel có thể được sử dụng rộng rãi như một thiết bị ổn định hoặc loại bỏ đối lưu với sự cản trở tương đối thấp của ma sát lên sự chuyển động của các đại phân tử. Vật liệu có nồng độ cao hoặc mật độ các liên kết chéo của các monomer lớn được sử dụng để tạo ma sát dùng trong việc sàng lọc phân tử. Sàng lọc phân tử là tình huống trong đó độ linh động điện di và sự di chuyển của dung dịch được xác định chủ yếu thông qua độ nhớt và kích thước lỗ rỗng, kết quả là sự di chuyển của các đại phân tử trong hệ thống sẽ cơ bản được xác định bởi khối lượng phân tử của chúng.
Rất nhiều tác nhân dạng gel đã được sử dụng trong hệ thống điện di, trong đó gel agarose (polymer polygalactose) được sử dụng khá phổ biến, đặc biệt là trong ứng dụng với những đa phân tử như acid nucleic, lipoprotein v.v. Gel polyacrylamide là một trong những tác nhân hữu ích và linh hoạt nhất sử dụng trong phân tách điện di bởi vì nó dễ dàng giải quyết một loạt các protein và acid nucleic (bảng 4-1 và 4-2 hướng dẫn cách chuẩn bị gel SDS-PAGE và gel polyacrylamide cho mẫu acid nucleic có khối lượng phân tử nhỏ).
Gel polyacrylamide được hình thành từ quá trình polymer hóa acryamide (đơn phân tử) và N,N&-methylene-bis-acrylamide (liên kết chéo) (Hình 5).

Hình 5: Cấu hình gel polyacrylamide.
Acrylamide đơn phân tử và dạng liên kết chéo tự bản thân nó tồn tại ở trạng thái bền hoặc được trộn ở trong dung dịch, nhưng polymer dễ dàng xuất hiện trong hệ thống tạo gốc tự do. Các nhà hóa sinh sử dụng các nguồn gốc tự do hóa học hoặc hóa quang để tạo ra quá trình polymer hóa. Đối với phương pháp hóa học (phương pháp được sử dụng phổ biến nhất) chất khởi tạo gốc tự do là amoni persulfate (APS) được thêm vào cùng với chất xúc tác N,N,N&,N&-tetramethylethylenediamine (TEMED). Hai thành phần nêu trên cùng với đơn phân tử, thành phần liên kết chéo và hệ đệm phù hợp sẽ tạo thành gốc tự do thích hợp để tạo ra sự polymer hóa. Đối với quá trình quang hóa (ít được sử dụng hơn), amoni persulfate được thay thế bởi thành phần nhạy ánh sáng (ví dụ riboflavin) để tạo ra gốc tự do khi nó bị chiếu bằng tia cực tím. Có thể thay đổi để tạo ra loại gel sử dụng phù hợp với từng ứng dụng. Nếu ứng dụng yêu cầu lỗ có kích thước lớn bạn có thể giảm lượng đơn phân tử hoặc (và) liên kết chéo trong dung dịch, ngược lại có thể tăng nồng độ của đơn phân tử hoặc liên kết chéo (hoặc cả hai) để giảm kích thước lỗ.
Yêu cầu về kích thước lỗ cho từng quá trình phân tách điện di cụ thể sẽ phụ thuộc vào kích cỡ khác nhau của hợp chất mà bạn sẽ xử lý. Ví dụ, nếu bạn muốn xử lý hai protein cỡ nhỏ có kích thước 8000 Da và 6000 Da thì bạn cần phải có loại gel với kích thước lỗ nhỏ (15 đến 20% acrylamide) nhưng loại gel này sẽ không cho độ phân giải đối với hai protein lớn hơn với kích thước 150000 Da và 130000 Da, trong trường hợp này ta phải sử dụng loại gel có kích thước lỗ lớn hơn (với nồng độ acrylamide từ 7.5 đến 10%). Bảng 1 chỉ ra phạm vi phân tách protein hiệu quả của gel với các phần trăm acrylamide khác nhau.
Bảng 1: Hiệu quả phân tách của gel polyacrylamide ở các nồng độ khác nhau đối với việc sử dụng SDS-PAGE
Tài liệu tham khảo:
Biomedia.vn dịch lược
Robert L. Switzer, Liam F. Garrity (1999), Experimental Biochemistry third edition, ISBN-13: 978-0716733003, New York.
Điện di là quá trình dịch chuyển của phân tử tích điện trong dung dịch dưới tác dụng của điện trường. Điện di thường được phân loại dựa vào sự có mặt hoặc vắng mặt của môi trường hoặc chất nền rắn nơi mà phân tử tích điện dịch chuyển. Hệ thống điện di dung dịch sử dụng hệ đệm dung dịch thay cho môi trường rắn, những hệ thống như vậy có thể chịu ảnh hưởng bởi sự xáo trộn mẫu do có sự khuếch tán của phân tử tích điện, làm giảm độ phân giải trong quá trình ứng dụng, phân tách và các bước loại bỏ mẫu. Như vậy hệ thống điện di dung dịch phải sử dụng một vài phương tiện nhằm ổn định dung dịch trong tế bào điện di. Ví dụ: hệ thống điện di độ chênh hòa tan sử dụng các chất tan không có ion với mật độ khác nhau (Vd: Đường sucrose hoặc glycerol) để giảm thiểu độ khuếch tán của vật chất được tách ra trong quá trình điện di như Hình 1. Nhưng ngay cả có những cải tiến thì hệ thống phân tách điện di vẫn còn hạn chế đó là khi dùng cho việc chuẩn bị tỷ lệ xích vật chất (preparative scale: preparative là một từ tối nghĩa, trong công nghệ sinh học nó có nghĩa là việc cô lập vài mili gram vật chất cho việc đánh giá hoạt động sinh lý học của nó) bằng phân tách điện di.Ứng dụng thiết thực nhất của phương pháp điện di trong công nghệ hóa sinh là điện di vùng (zonal electrophoresis), trong đó dung dịch ion có vai trò như một khuôn đỡ rắn và mẫu sẽ được đưa vào dưới dạng điểm hoặc băng vật chất. Giấy điện di, dải cellulose acetate, dải cellulose nitrate và gel điện di là những thành phần của hệ thống điện di (Hình 2). Những hệ thống này thông thông thường được sử dụng cho phân tích hơn là việc chuẩn bị tỷ lệ xích vật chất (preparative scale).Tất cả các dạng của hệ thống điện di đều tuân theo quy luật như trong phương trình (*) sau đây:(*) Độ linh động của phân tử =Độ linh động hoặc tốc độ chuyển động của phân tử tăng lên khi hiệu điện thế và điện tích của phân tử tăng lên và ngược lại độ linh động giảm khi ma sát giữa các phân tử hoặc độ nhớt của môi trường tăng làm cản trở dòng chảy. Tổng chuyển động thực tế của các phân tử tăng dần theo thời gian vì thế độ linh động được định nghĩa là tốc độ của sự di chuyển, phương trình (*) là phương trình cực kỳ quan trọng trong ngành hóa sinh thực nghiệm. Tất cả các hệ thống điện di đều sử dụng một hiệu điện thế bằng nhau và không đổi trên toàn bộ tiết diện cắt ngang của dải giấy, gel hay dung dịch dùng trong phân tách điện di. Đơn vị của điện trường là V/cm (độ lớn của nó được xác định bằng giá trị của điện áp), và theo định luật Ohm (V = IR) ta có điện áp V là hàm của dòng điện I và điện trở R, điện trở của hệ thống được quyết định bởi bản chất của thiết bị điện di và thành phần bộ đệm. Do đó dòng điện (vd: mA) thường được dùng để xác định yêu cầu về hiệu điện thế của phép phân tách điện di. Điện trở của hệ thống là thành phần rất quan trọng vì nó sẽ quyết định lượng nhiệt sinh ra trong quá trình điện di. Khi mà độ linh động điện di cũng phụ thuộc vào nhiệt độ do đó nhiệt độ của chất nền phân tách phải được điều khiển. Nếu một lượng nhiệt đủ lớn xuất hiện trong quá trình điện di thì yêu cầu hệ thống phải có một số thiết bị làm mát để duy trì được nhiệt độ không đổi trong suốt quá trình làm việc. Các mô hình “smiling” thường thấy trên phiến gel điện di là kết quả của sự gia nhiệt không đồng dạng của nó.Nếu điện áp hoặc dòng điện được cấp cho hệ thống điện di là không đổi trong suốt quá trình phân tách điện di thì độ linh động của phân tử sẽ phụ thuộc vào các thành phần là dòng điện tích và tính ma sát của phân tử trong mẫu. Xét quá trình phân tách điện di trên giấy của acid glutamine, este methyl asaparagine và glycinamide tại giá trị pH 6.0. Điện tích và khối lượng phân tử của các hợp chất được mô tả trong Hình 3.Ta thấy các acid amin cùng kích thước và este methyl asparagine được phân tách tuân theo hàm về điện tích của chúng ở giá trị pH 6.0 trong khi glycinamite (có cùng điện tích nhưng kích thước chỉ bằng nửa so với este methyl asparagines) lại di chuyển xa hơn về phía cực âm (-) của hệ thống.Nói chung các nguyên lý được minh họa trong Hình 3 có thể được sử dụng để minh họa tính linh động của phân tử ion cỡ nhỏ. Các nguyên lý này đặc biệt hữu ích cho việc tiên đoán khả năng phân tách điện di của các phân tử nhỏ chứa các nhóm có tính acid hoặc bazơ yếu, các phân tử này chỉ mang theo một phần điện tích trung bình trong dải pH liên quan đến phép chuẩn của chúng, ví dụ trong phân tách điện di của các nucleotide hoặc các acid amin.Sự phân tách điện di của các phân tử lớn hơn các đại phân tử tuân theo nguyên lý của phương trình (*) nhưng các yếu tố khác sẽ ảnh hưởng đến độ phân giải của các đại phân tử. Độ ma sát của phân tử trong quá trình di chuyển điện di bị ảnh hưởng bởi cả hai yếu tố là hình dạng và kích thước của phân tử. Nếu quá trình điện di được thực hiện trong một môi trường có các rào cản có tác dụng cản trở đáng kể sự chuyển động của các đại phân tử thông qua nó (ví dụ như hai hệ thống thường được dùng là polyacrylamide và agarose) lúc này kích thước phân tử được chứng minh là yếu tố quan trọng nhất quyết định tính linh động của nó. Nếu tỷ lệ điện tích/khối lượng của đại phân tử được phân tách là xấp xỉ như nhau thì kích thước của phân tử là yếu tố duy nhất ảnh hưởng đến tính di động điện di. Những điều kiện này đang được sử dụng để xác định khối lượng phân tử của tiểu phần protein bằng phương pháp điện di trên gel polyacrylamide có chứa natri dodecyl sunphát (SDS-PAGE), và trong phân tách điện di của các thang oligonucleotide trong quá trình giải trình tự ADN. Đối với phân tử cỡ nhỏ có các liên kết có thể xoay tự do, do đó hình dạng phân tử không ảnh hưởng nhiều đến ma sát, nên điều quyết định chính đến độ ma sát là kích thước của phân tử. Tuy nhiên các đại phân tử thường có hình dạng xác định với tỷ lệ cụ thể của các trục (ví dụ tỷ lệ chiều dài với chiều rộng) kết quả là cả hình dạng và kích thước đều ảnh hưởng tới sự di chuyển của phân tử. Phân tử có tỷ lệ lớn giữa các trục (hình dạng thuôn dài) thể hiện tính linh động trong quá trình điện di thấp hơn so với phân tử dạng hình cầu có điện tích và khối lượng bằng nhau. Ngoài ra các đại phân tử có tính linh động không giống với nguyên lý điện di từ phương trình (*) bởi vì sự tương tác của nó với các ion hoặc do sự phụ thuộc của điện tích vào sự liên kết của các nội phân tử.2. Các dạng đặc trưng của điện di thường được sử dụng trong công nghệ sinh học– Điện di giấy ( Paper Electrophoresis): Điện di trên giấy là phương pháp điện di thường được sử dụng để phân tích và phân giải các phân tử cỡ nhỏ. Phương pháp này không được sử dụng để phân giải các đại phân tử (ví dụ protein…) bởi vì sự hấp thụ và sức căng bề mặt liên kết với giấy điện di thường làm thay đổi hoặc biến tính các đại phân tử tạo ra độ phân giải kém.Có hai phương pháp điện di giấy.Đối với quy trình khô, mẫu của chất tan được hòa tan trong nước hoặc một bộ đệm dễ bay hơi sau đó nó được nhỏ một giọt nhỏ hoặc sọc mỏng lên đường gốc (origin line) hoặc đường chì (pencil line) trên giấy, sau đó các hợp chất tiêu chuẩn thích hợp đã biết được đưa vào các vị trí khác trên đường gốc của giấy. Nếu bạn dự đoán được rằng sự di chuyển điện di sẽ về cả hai phía điện cực của hệ thống thì đường gốc nên được đặt tại tâm của giấy, còn nếu sự di chuyển điện di chỉ theo một hướng điện cực thì đường gốc nên được đặt tại gần một đầu (rìa) của giấy. Sau khi dung môi hòa tan có chứa các mẫu đã bay hơi hết, giấy được làm ẩm với đệm điện di bằng cách phun đồng nhất hoặc ngâm thấm các đầu của tờ giấy để làm ẩm cả 2 đầu và đường gốc của nó.Quy trình ướt, mẫu dung dịch cô đặc trong nước cất được nhỏ lên trên giấy trước khi được làm ẩm với đệm điện di. Quy trình khô có lợi thế so với quy trình ướt đó là cho phép điểm mẫu ban đầu nhỏ và độ phân giải tốt hơn đối với những hợp chất có cùng độ linh động. Tuy nhiên quy trình khô khá bất tiện bởi vì việc nhúng và phun đòi hỏi kỹ năng thao tác để ngăn việc làm dây mẫu ra ngoài. Quy trình ướt đơn giản hơn nhiều nhưng giọt mẫu điểm thường lớn hơn và độ phân giải thu được kém hơn do sự khuếch tán của mẫu.Sau khi mẫu được đặt lên mảnh giấy ẩm, giấy này được đưa vào buồng điện di để cho cả hai đầu của giấy đều tiếp xúc với bình chứa bộ đệm điện di và các điện cực (Hình 4). Nếu đường gốc không nằm tại tâm của tờ giấy thì tờ giấy phải được định vị sao cho có thể cho phép tối đa sự di chuyển về phía điện cực mong muốn. Sau đó buồng điện di được đóng lại để ngăn sốc điện và điện trường sẽ được cấp cho hệ thống.Dưới tác dụng của điện trường và điện trở lên dòng điện, bộ đệm giấy sinh ra nhiệt, đây là vấn đề lớn và khó khăn nhất đối với phương pháp điện di trên giấy bởi vì nhiệt sinh ra có tác dụng sấy khô giấy làm cản trở dòng điện và kết quả làm cho điện trở lại tăng lên v.v. Kể cả nếu ta có thể ngăn chặn quá trình bị sấy khô của giấy bởi nhiệt thì lượng nhiệt sinh ra này vẫn làm thay đổi tính chất dòng điện và trở kháng của hệ thống làm biến dạng sự di chuyển của phân tử.Bởi vì những khó khăn trên nên các hệ thống điện di trên giấy hiện đại đã được thiết kế để khắc phục những vấn đề về nhiệt lượng sinh ra. Hầu hết các thiết bị sử dụng điện áp thấp được thiết kế dưới dạng nhỏ gọn cơ động và nó có thể được vận hành trong phòng lạnh hoặc trong buồng đông lạnh. Ngược lại các thiết bị sử dụng điện áp cao thường sử dụng hệ thống làm mát dạng giường phẳng hoặc được vận hành trong một bồn làm mát chứa dung môi trơ và không phân cực (ví dụ: Varso-một sản phẩm từ chưng cất dầu mỏ). Dung dịch này hấp thụ nhiệt tỏa ra từ hệ thống mà không cần trộn với nước, bộ đệm hoặc các mẫu trên giấy (Hình 4). Sau khi điện di các mẫu trên giấy với thời gian và điện áp yêu cầu cho sự phân tách tối ưu, dòng điện sẽ được ngắt, giấy được lấy ra khỏi hệ thống và được sấy khô sau đó ta có thể xác định được sự hiện diện và vị trí của các phân tử cần quan tâm.– Điện di mao quản (Capillary Electrophoresis): Đây là một phương pháp mới cho sự phân tích điện di và có ứng dụng ngày càng nhiều trong nghiên cứu sinh hóa.Tên của phương pháp đã giúp ta phần nào đoán được nguyên lý hoạt động của nó, trong đó vật chất được phân tích và môi trường điện di được đặt trong một ống mao dẫn mịn, dài (thông thường dài từ 50 đến 100cm và đường kính trong từ 15 đến 100 μm). Một lượng mẫu rất nhỏ (cỡ nano lít) được đặt tại một đầu của ống mao dẫn và chịu sự điện di dưới trường tạo bởi điện áp từ 20 đến 30kV. Chất phân tích sẽ được phân tách tuân theo nguyên lý của phương trình (*) và được phát hiện khi chúng xuất hiện ở đều bên kia của ống mao dẫn thông thường là bằng phương pháp sắc kí lỏng hiệu năng cao. Ưu điểm của điện di mao dẫn là nó cho độ phân giải cực cao, tốc độ và độ nhạy cao đối với việc phân tích các mẫu rất nhỏ nhưng rõ ràng nó không thực sự hữu ích trong phương pháp chuẩn bị vật liệu (preparative). Nó thường sử dụng trong việc phân tách các phân tử ADN có kích thước khác nhau chỉ một nucleotit đơn lẻ. Bởi vì phương pháp điện di mao dẫn có độ phân giải rất cao, nên nó là cơ sở để phân tách các polynucleotide trong trình tự ADN kiểu mới. Phương pháp điện di mao dẫn cũng phù hợp với sự phân tách các phân tử không tích điện bằng cách thêm các vi hạt tích điện vào trong môi trường dung dịch điện di. Nếu hỗn hợp dung dịch hòa tan được ngăn cách giữa môi trường nước và phần kỵ nước bên trong của vi hạt được đưa vào trong hệ thống này thì chúng có thể được phân tách bằng phương pháp điện di. Điện di mao dẫn là một phương pháp có tính linh động cao, phạm vi ứng dụng và phương pháp tối ưu hóa cho nó vẫn đang được nghiên cứu.– Điện di trên gel ( Gel Electrophoresis): Đối với phương pháp điện di trên gel, phân tử được phân tách trong hệ đệm lỏng được hỗ trợ trong một chất nền polime. Hệ thống điện di trên gel có một số ưu điểm rõ rệt. Đầu tiên, chúng có thể thích hợp trên những mẫu lớn hơn so với hầu hết các hệ thống điện di giấy, và cũng có thể sử dụng cho việc chuẩn bị tỷ lệ xích (preparative scale) cho các đại phân tử. Thứ hai là tính chất của chất nền gel có thể thay đổi theo ý muốn để phù hợp với những ứng dụng cụ thể, bởi vì gel làm tăng độ ma sát và điều chỉnh sự linh động điện di (xem phương trình (*)). Vật liệu để làm chất nền có nồng độ thấp hoặc mức độ thấp các liên kết chéo của các monomer trong hệ thống gel có thể được sử dụng rộng rãi như một thiết bị ổn định hoặc loại bỏ đối lưu với sự cản trở tương đối thấp của ma sát lên sự chuyển động của các đại phân tử. Vật liệu có nồng độ cao hoặc mật độ các liên kết chéo của các monomer lớn được sử dụng để tạo ma sát dùng trong việc sàng lọc phân tử. Sàng lọc phân tử là tình huống trong đó độ linh động điện di và sự di chuyển của dung dịch được xác định chủ yếu thông qua độ nhớt và kích thước lỗ rỗng, kết quả là sự di chuyển của các đại phân tử trong hệ thống sẽ cơ bản được xác định bởi khối lượng phân tử của chúng.Rất nhiều tác nhân dạng gel đã được sử dụng trong hệ thống điện di, trong đó gel agarose (polymer polygalactose) được sử dụng khá phổ biến, đặc biệt là trong ứng dụng với những đa phân tử như acid nucleic, lipoprotein v.v. Gel polyacrylamide là một trong những tác nhân hữu ích và linh hoạt nhất sử dụng trong phân tách điện di bởi vì nó dễ dàng giải quyết một loạt các protein và acid nucleic (bảng 4-1 và 4-2 hướng dẫn cách chuẩn bị gel SDS-PAGE và gel polyacrylamide cho mẫu acid nucleic có khối lượng phân tử nhỏ).Gel polyacrylamide được hình thành từ quá trình polymer hóa acryamide (đơn phân tử) và N,N&-methylene-bis-acrylamide (liên kết chéo) (Hình 5).Acrylamide đơn phân tử và dạng liên kết chéo tự bản thân nó tồn tại ở trạng thái bền hoặc được trộn ở trong dung dịch, nhưng polymer dễ dàng xuất hiện trong hệ thống tạo gốc tự do. Các nhà hóa sinh sử dụng các nguồn gốc tự do hóa học hoặc hóa quang để tạo ra quá trình polymer hóa. Đối với phương pháp hóa học (phương pháp được sử dụng phổ biến nhất) chất khởi tạo gốc tự do là amoni persulfate (APS) được thêm vào cùng với chất xúc tác N,N,N&,N&-tetramethylethylenediamine (TEMED). Hai thành phần nêu trên cùng với đơn phân tử, thành phần liên kết chéo và hệ đệm phù hợp sẽ tạo thành gốc tự do thích hợp để tạo ra sự polymer hóa. Đối với quá trình quang hóa (ít được sử dụng hơn), amoni persulfate được thay thế bởi thành phần nhạy ánh sáng (ví dụ riboflavin) để tạo ra gốc tự do khi nó bị chiếu bằng tia cực tím. Có thể thay đổi để tạo ra loại gel sử dụng phù hợp với từng ứng dụng. Nếu ứng dụng yêu cầu lỗ có kích thước lớn bạn có thể giảm lượng đơn phân tử hoặc (và) liên kết chéo trong dung dịch, ngược lại có thể tăng nồng độ của đơn phân tử hoặc liên kết chéo (hoặc cả hai) để giảm kích thước lỗ.Yêu cầu về kích thước lỗ cho từng quá trình phân tách điện di cụ thể sẽ phụ thuộc vào kích cỡ khác nhau của hợp chất mà bạn sẽ xử lý. Ví dụ, nếu bạn muốn xử lý hai protein cỡ nhỏ có kích thước 8000 Da và 6000 Da thì bạn cần phải có loại gel với kích thước lỗ nhỏ (15 đến 20% acrylamide) nhưng loại gel này sẽ không cho độ phân giải đối với hai protein lớn hơn với kích thước 150000 Da và 130000 Da, trong trường hợp này ta phải sử dụng loại gel có kích thước lỗ lớn hơn (với nồng độ acrylamide từ 7.5 đến 10%). Bảng 1 chỉ ra phạm vi phân tách protein hiệu quả của gel với các phần trăm acrylamide khác nhau.Bảng 1: Hiệu quả phân tách của gel polyacrylamide ở các nồng độ khác nhau đối với việc sử dụng SDS-PAGEBiomedia.vn dịch lượcRobert L. Switzer, Liam F. Garrity (1999), Experimental Biochemistry third edition, ISBN-13: 978-0716733003, New York.
