Dưới đây là danh sách tính chất hóa học của iot hay nhất do chính tay đội ngũ chúng tôi biên soạn và tổng hợp:
Video Tính chất hóa học của iot
Tính chất của Iot (I): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
I. Trạng thái tự nhiên
– So với các halogen khác, iot có trong vỏ trái đất ít nhất.
– Hợp chất iot có trong nước biển nhưng rất ít.
Liên quan: tính chất hóa học của iot
– Iot còn có trong tuyến giáp của người tuy nhỏ nhưng rất quan trọng vì nếu thiếu sẽ bị bệnh bướu cổ.
II. Tính chất
1. Tính chất vật lý
– Iot là tinh thể màu đen tím, có vẻ sáng kim loại.
– Hiện tượng thăng hoa:
+ Đun nóng, iot không nóng chảy mà biến thành thể hơi.
+ Làm lạnh, hơi iot chuyển thành tinh thể, không thông qua thể lỏng.
– Ít tan trong nước, tan nhiều trong dung môi hữu cơ.
2. Tính chất hóa học
a. Tác dụng với kim loại
– Iot oxi hóa được nhiều kim loại nhưng chỉ xảy ra khi đun nóng hoặc có xúc tác.

b. Tác dụng với hidro
H2 + I2 → 2HI phản ứng xảy ra thuận nghịch.
– Hidro Iotua dễ tan trong nước tạo thành dd axit Iothidric, đó là 1 axit rất mạnh, mạnh hơn cả axit clohidric, bromhidric.
– Iot hầu như không tác dụng với H2O.
c. Iot có tính oxi hóa kém clo và brom:
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
d. Tính khử của axit HI
– HI có tính khử mạnh có thể khử được axit H2SO4 đặc.
8HI + H2SO4 → 4I2 + H2S + 4H2O
2HI + 2FeCl3 → FeCl2 + I2 + 2HCl
e. Tính chất đặc trưng của Iot
– Iot có tính chất đặc trưng là tác dụng với hồ tinh bột tạo thành hợp chất có màu xanh.
III. Ứng dụng, điều chế
1. Ứng dụng
– Dùng nhiều dưới dạng cồn iot (dd iot 5% trong ancol etylic) làm chất sát trùng.
– Có trong thành phần của nhiều dược phẩm.
– Trộn với lượng nhỏ KI và KIO3 thành muối iot giúp tránh các rối loạn do thiếu iot.
2. Điều chế
Cl2 + 2NaI → 2NaCl + I2
IV. Một số hợp chất của iot
1. Hidro iotua và axit iothidric
– HI kém bền với nhiệt, bị phân hủy thành I2 ở 300oC.
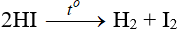
– Là axit mạnh, có tính khử mạnh:
8HI + H2SO4 → 4I2 + H2SO4 + 4H2O
2HI + 2FeCl3 → 2FeCl2 + I2 + 2HCl
2. Một số hợp chất khác
– Muối của axit iothidric đa số dễ tan trong nước.
– Một số muối iot không tan và có màu. Ví dụ: AgI màu vàng, PbI2 màu vàng.
– Ion iotua bị oxi hóa khi tác dụng với clo và brom:
2NaI + Cl2 → 2NaCl + I2
2NaI + Br2 → 2NaBr + I2
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi THPT Quốc gia khác:
-
Lý thuyết Khái quát về nhóm Halogen
-
Lý thuyết Clo
-
Lý thuyết Hidro clorua – Axit Clohidric (HCl) và muối clorua
-
Lý thuyết Hợp chất chứa Oxi của Clo
-
Lý thuyết Flo
-
Lý thuyết Brom
-
Lý thuyết Nhận biết Nhóm Halogen
- Lý thuyết về clo và hợp chất của clo
- Tóm tắt lý thuyết Hóa 10 chương 5
Giới thiệu kênh Youtube VietJack
Ngân hàng trắc nghiệm lớp 10 tại banmaynuocnong.com
- Hơn 7500 câu trắc nghiệm Toán 10 có đáp án
- Hơn 5000 câu trắc nghiệm Hóa 10 có đáp án chi tiết
- Gần 4000 câu trắc nghiệm Vật lý 10 có đáp án
